A. Proton
Eugen Goldstein pada tahun 1886 melakukan percobaan dengan memodifikasi tabung sinar katode yang ditemukan oleh William Crookes dengan cara melobangi lempeng katode. Dari percobaan ini ditemukan bahwa gas yang berada di belakang katode menjadi berpijar. Hal ini berarti radiasi dari anode menembus lempengan katode melalui lubang yang sebelumnya telah dibuat.
- Sifat sinar anode ini yaitu:
Merupakan radiasi partikel karena mampu memutar baling-baling. - Radiasi ini bila dibelokkan menggunakan medan magnet, maka akan menuju ke kutub magnet negatif. Itu artinya radiasi sinar ini bermuatan positif (itulah sebabkan kemudian dinamakan anode yang kemudian dinamakan proton).
- Partikel sinar anode bergantung pada jenis gas yang ada di dalam tabung.
- Sifat sinar anode ini yaitu:
Massa proton terkecil diperoleh pada atom Hidrogen yaitu Massa 1 proton = 1 sma = 1,66 × 10-24 gram dengan muatan 1 proton = +1 = 1,6 × 10-19 C.
B. Elektron
Joseph John Thomson pada tahun 1897 melakukan percobaan dengan menggunakan tabung sinar katode. Terdapat dua plat elektroda dimana salah satu plat logam yang terdapat pada ujung tabung berfungsi sebagai katoda. Kedua plat ini dimasukkan ke dalam tabung kaca bertekanan rendah kemudian dialirkan listrik bertegangan tinggi hingga mampu melepas elektron dari katoda ke anoda. Sinar katoda tidak dapat kita lihat menggunakan mata telanjang namun kita bisa mengetahui bahwa sinar ini ada dari berpenjarnya lapisan tabung kaca bagian dalam akibat adanya benturan antara elektron dengan dinding tabung. Atau kita bisa melihatnya jika sinar katoda kita benturkan ke layar ber-fluoresensi (layar yang dapat berpendar) setelah terlebih dahulu kita beri lubang pada plat logam anoda. Seperti gambar di bawah ini.
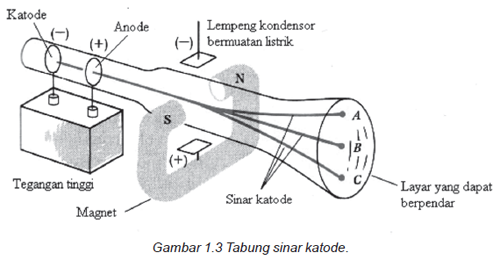
Dari hasil percobaannya ditemukan sifat sinar katode yaitu:
- Merupakan radiasi partikel karena mampu memutar baling-baling.
- Radiasi ini bila dibelokkan menggunakan medan magnet, maka akan menuju ke kutub magnet positif. Itu artinya sinar katode bermuatan negatif.
- Partikel katoda merambat tegak lurus dari lempengan katode menuju anode.
- Sinar katoda tidak tergantung pada jenis plat logam yang digunakan.
- Sinar katoda dapat kita buat dengan listrik tegangan tinggi.
Dari sifat inilah kemudian oleh J.J Thomson menamakan partikel penyusun atom bermuatan negatif ini sebagai elektron. Setelain ini J.J Thomson juga menemukan perbandingan muatan elektron terhadap massa yaitu 1,76 × 108 C/g yang kemudian pada tahun 1909, Robert Millikan berhasil menemukan besarnya muatan sebuah elektron yaitu 1,6 × 10-19 C. Dengan demikian, maka kita peroleh massa 1 elektron sebesar 9,1095×10-31 Kg.
C. Neutron
Setelah ditemukan adanya proton di dalam inti atom, didapati bahwa ternyata massa inti atom selalu lebih besar daripada proton. Darisinilah kemudian para peneliti berpendapat bahwa ada partikel lain di dalam inti (selain proton) yang muatannya netral.
W. Bothe dan H. Becker pada tahun 1930 melakukan penembakan menggunakan partikel alpha (α) ke inti atom berilium. Ditemukan adanya radiasi partikel yang memiliki daya tembus besar. Dua tahun sesudahnya yaitu tahun 1932, James Chadwick melakukan penelitian lebih lanjut dimana ditemukan bahwa partikel tersebut bermuatan netral dan memiliki massa hampir sama dengan partikel proton (bermuatan positif). Partikel ini kemudian dinamakan sebagai neutron.
W. Bothe dan H. Becker pada tahun 1930 melakukan penembakan menggunakan partikel alpha (α) ke inti atom berilium. Ditemukan adanya radiasi partikel yang memiliki daya tembus besar. Dua tahun sesudahnya yaitu tahun 1932, James Chadwick melakukan penelitian lebih lanjut dimana ditemukan bahwa partikel tersebut bermuatan netral dan memiliki massa hampir sama dengan partikel proton (bermuatan positif). Partikel ini kemudian dinamakan sebagai neutron.
Bilangan Kuantum
Bilangan kuantum (dalam fungsi gelombang) adalah bilangan yang memiliki makna khusus dalam menjelaskan keadaan sistem kuantum. Bilangan-bilangan kuantum dapat memberikan deskripsi keadaan elektron dalam atom.
Bilangan kuantum (bahasa Inggris: Quantum number) adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital.[1]
Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.[2]
Bilangan kuantum merupakan salah satu ciri khas dari model atom mekanika kuantum atau model atom modern yang dicetuskan oleh Erwin Schrödinger. Dalam mekanika kuantum, bilangan kuantum diperlukan untuk menggambarkan distribusi elektron dalam atom hidrogen dan atom-atom lain. Bilangan-bilangan ini diturunkan dari penyelesaian matematis persamaan Schrödinger untuk atom hidrogen.
Bilangan kuantum utama (primer) digunakan untuk menyatakan tingkat energi utama yang dimiliki oleh elektron dalam sebuah atom. Bilangan kuantum utama tidak pernah bernilai nol. Bilangan kuantum utama dapat mempunyai nilai semua bilangan positif, yaitu 1,2,3,4 dan seterusnya. Sedangkan kelopak atom dinyatakan dengan huruf K,L,M,N dan seterusnya.
contoh:
n=1 elektron berada pada kelopak K;
n=2 elektron berada pada kelopak L;
n=3 elektron berada pada kelopak M;
n=4 elektron berada pada kelopak N; dan seterusnya
Bilangan kuantum utama juga berhubungan dengan jarak rata-rata elektron dari inti dalam orbital tertentu. Semakin besar n, semakin besar jarak rata-rata elektron dalam orbital tersebut dari inti dan oleh karena itu semakin besar orbitalnya.
Bilangan kuantum azimut sering disebut bilangan kuantum anguler (sudut). Energi sebuah elektron berhubungan dengan gerakan orbital yang digambarkan dengan momentum sudut. Momentum sudut tersebut dikarakterisasi menggunakan bilangan kuantum azimut. Bilangan azimut menyatakan bentuk suatu orbital dengan simbol  "huruf L kecil". Bilangan kuantum azimut juga berhubungan dengan jumlah subkelopak. Nilai ini menggambarkan subkelopak yang dimana elektron berbeda. Untuk subkelopak s, p, d, f bilangan kuantum azimut berturut-turut adalah 0,1,2,3[2].
"huruf L kecil". Bilangan kuantum azimut juga berhubungan dengan jumlah subkelopak. Nilai ini menggambarkan subkelopak yang dimana elektron berbeda. Untuk subkelopak s, p, d, f bilangan kuantum azimut berturut-turut adalah 0,1,2,3[2].
Nilai bilangan kuantum azimut atau " " ini bergantung pada nilai bilangan kuantum utama atau "n" . Untuk nilain tertentu,
" ini bergantung pada nilai bilangan kuantum utama atau "n" . Untuk nilain tertentu,  mempunyai nilai bilangan bulat yang mungkin dari 0 sampai (n-1). Bila n-1, hanya ada satu nilai
mempunyai nilai bilangan bulat yang mungkin dari 0 sampai (n-1). Bila n-1, hanya ada satu nilai  yakni
yakni  . Bila n=2, ada dua nilai
. Bila n=2, ada dua nilai  , yakni 0 dan 1. Bila n=3, ada tiga nilai
, yakni 0 dan 1. Bila n=3, ada tiga nilai  , yakni 0,1, dan 2. Nilai-nilai
, yakni 0,1, dan 2. Nilai-nilai  biasanya ditandai dengan huruf s, p, d, f... sebagai berikut:[3]
biasanya ditandai dengan huruf s, p, d, f... sebagai berikut:[3]
Jadi bila  =0, kita mempunyai sebuah orbital s; bila
=0, kita mempunyai sebuah orbital s; bila  =1, kita mempunyai orbital f; dan seterusnya.
=1, kita mempunyai orbital f; dan seterusnya.
Sekumpulan orbital-orbital dengan nilai n yang sama seringkali disebut kulit. Satu atau lebih orbital dengan nilai n dan  yang sama dirujuk selalu subkelopak. Misalnya kelopak dengan n=2 terdiri atas 2 subkelopak,
yang sama dirujuk selalu subkelopak. Misalnya kelopak dengan n=2 terdiri atas 2 subkelopak,  =0 dan 1 (nilai-nilai
=0 dan 1 (nilai-nilai  yang diizinkan untuk n=2). Subkelopak-subkelopak ini disebut subkelopak 2s dan subkelopak 2p di mana 2 melambangkan nilai n, sedangan s dan p melambangkan nilai
yang diizinkan untuk n=2). Subkelopak-subkelopak ini disebut subkelopak 2s dan subkelopak 2p di mana 2 melambangkan nilai n, sedangan s dan p melambangkan nilai  .Tabel di bawah ini menunjukkan keterkaitan jumlah kelopak dengan banyaknya subkelopak serta jenis subkelopak dalam suatu atom.
.Tabel di bawah ini menunjukkan keterkaitan jumlah kelopak dengan banyaknya subkelopak serta jenis subkelopak dalam suatu atom.
Bilangan kuantum magnetik menyatakan tingkah laku elektron dalam medan magnet. Tidak adanya medan magnet luar membuat elektron atau orbital mempunyai nilai n dan l yang sama tetapi berbeda m. Namun dengan adanya medan magnet, nilai tersebut sedikit berubah. Hal ini dikarenakan timbulnya interaksi antara medan magnet sendiri dengan medan magnet luar[2].
Bilangan kuantum magnetik ada karena momentum sudut elektron, gerakannya berhubungan aliran arus listrik. Karena interaksi ini, elektron menyesuaikan diri di wilayah tertentu sekitar inti. Daerah khusus ini dikenal sebagai orbital. Orientasi elektron di sekitar inti dapat ditentukan dengan menggunakan bilangan kuantum magnetik m [2].
Di dalam satu subkulit, nilai m bergantung pada nilai bilangan kuantum azimut/momentum sudut l. Untuk nilai l tertentu, ada (2l + 1) nilai bulat m sebagai berikut: -l, (-l + 1), ..., 0, ..., (+l - 1), +l
Bila l =0, maka m=0. Bila l =1, maka terdapat tiga nilai m yaitu -1,0,dan -1. Bila l =2, maka terdapat lima nilai m yaitu -2,-1,0,+1, dan +2. Jumlah m menunjukkan jumlah orbital dalam subkulit dengan nilai l tertentu.
Bilangan kuantum spin menyatakan momentum sudut suatu partikel. Spin mempunyai simbol "s" atau sering ditulis dengan ms (bilangan kuantum spin magnetik). Suatu elektron dapat mempunyai bilangan kuantum spin s = +1/2 atau -1/2[1].
Nilai positif atau negatif dari spin menyatakan spin atau rotasi partikel pada sumbu. Sebagai contoh, untuk nilai s=+1/2 berarti berlawanan arah jarum jam (ke atas), sedangkan s=-1/2 berarti searah jarum jam (ke bawah). Diambil nilai setengah karena hanya ada dua peluang orientasi, yaitu atas dan bawah. Dengan demikian, peluang untuk mengarah ke atas adalah 50% dan peluang untuk ke bawah adalah 50%.
Macam-macam bentuk orbital
a. Orbital s
Orbital yang paling sederhana adalah orbital s. Setiap subkulit s terdiri atas 1 buah orbital yang berisi 2 elektron. Orbital s berbentuk bola simetri yang menunjukkan bahwa elektron memiliki kerapatan yang sama, jika jarak dari inti atom juga sama. Semakin jauh letak elektron dari inti atom, kerapatannya semakin rendah. Nilai bilangan kuantum utama suatu orbital memengaruhi ukuran orbital. Semakin besar nilai bilangan kuantum utama, ukuran orbitalnya juga semakin besar.
 |
| Gambar 2. Bentuk orbital s. |
b. Orbital p
Bentuk orbital p seperti balon terpilin (cuping-dumbbell). Kepadatan elektron tidak tersebar merata, melainkan terkonsentrasi dalam dua daerah yang terbagi sama besar dan terletak pada dua sisi berhadapan dari inti yang terletak di tengah.
Subkulit p terdiri atas 3 orbital, tiap orbital mempunyai bentuk yang sama. Perbedaan ketiga orbital terletak pada arah, di mana terkonsentrasinya kepadatan elektron. Biasanya orbital p digambarkan menggunakan satu kumpulan sumbu x, y, dan z, sehingga diberi tanda px, py dan pz.
Pada subkulit p ini terdapat 3 nilai m (–1, 0, +1) sehingga terdapat 3 orientasi yang satu dan lainnya membentuk sudut 90 o. [1]
 |
| Gambar 4. Orbital p digambar menggunakan satu kumpulan sumbu xyz. |
c. Orbital d
Orbital d memiliki 5 orbital dengan bentuk yang kompleks dan orientasi yang berbeda. Empat orbital pertama memiliki bentuk yang sama, sedangkan satu orbital memiliki bentuk yang berbeda. Kelima orbital itu adalah dxy, dxz, dyz, dx2y2, dan dz2.
Untuk lebih jelas, perhatikan gambaran orbital subkulit d di bawah ini.
 |
| Gambar 5. bentuk orbital dxy, dxz, dyz, dx2y2, dan dz2 |
Setiap orbital mempunyai 4 “lobe” kepadatan elektron. Adapun perbedaannya terletak pada arah berkumpulnya kepadatan elektron. Sementara itu, satu orbital lagi mempunyai bentuk berbeda, tetapi memiliki energi yang sama dengan keempat orbital d lainnya.
d. Orbital f
Orbital f mempunyai bentuk orbital yang lebih rumit dan lebih kompleks daripada orbital d. Setiap subkulit f mempunyai 7 orbital dengan energi yang setara.
 |
| Gambar 6. Bentuk orbital f. [3] |
Orbital f (mempunyai 7 orbital) dan dikelompokan menjadi tiga kelompok, yaitu : [1]
1) kelompok pertama : fxyz
2) kelompok kedua : fx(z2 - y2), fy(z2 - x2), fz(x2 - y2)
3) kelompok ketiga : fx3, fy3, fz3
Orbital ini hanya digunakan untuk unsur-unsur transisi yang letaknya lebih dalam.
Materi Kimia :
Distribusi kerapatan elektron dalam orbital 1s, 2s, dan 3s dalam suatu atom. Bila suatu area banyak titiknya menunjukkan kerapatan elektron tinggi. Sedangkan daerah dalam ruang dengan tidak adanya kebolehjadian ditemukan elektron disebut simpul.
Materi Kimia :
Distribusi kerapatan elektron dalam orbital 1s, 2s, dan 3s dalam suatu atom. Bila suatu area banyak titiknya menunjukkan kerapatan elektron tinggi. Sedangkan daerah dalam ruang dengan tidak adanya kebolehjadian ditemukan elektron disebut simpul.
Daftar Pustaka
https://id.m.wikipedia.org/wiki/Bilangan_kuantumhttp://www.nafiun.com/2013/04/orientasi-dan-bentuk-orbital-s-p-d-f-elektron-bilangan-kuantum-atom.html?m=1
https://www.academia.edu/28441912/Partikel_Penyusun_Atom



Sangat lengkap bagus sekali
BalasHapusBagus banget
BalasHapusBaguss, sangat membantu👍😊
BalasHapusSangat membantu untuk mempelajari lebih dalam studi kimia
BalasHapusSangat membantu untuk mempelajari lebih dalam studi kimia
BalasHapusSangat bermanfaat dan sangat rinci
BalasHapusBagus & sangat bermanfaat. Ke depannya mungkin bisa gunakan litelatur seperti jurnal yg valid agar materi bisa dipertanggungjawabkan.
BalasHapusBagus dan tingkatkan kedepannya👌
BalasHapusSangat membantu
BalasHapusNice..ditunggu postingan selanjutnyaa
BalasHapus7
BalasHapusMuantep dehh 👌
Sangat membantu dalam mencari materi kimia
BalasHapus